Bài viết Viêm gan B và thai kỳ của tác giả Hannah Lee, MD, Anna SF Lok, MD được biên dịch bởi Bs. Vũ Tài.
1. Giới thiệu
Nhiễm vi-rút viêm gan B (HBV) trong thai kỳ gây ra các vấn đề quản lý duy nhất cho cả mẹ và thai nhi. Chúng bao gồm ảnh hưởng của HBV đến sức khỏe mẹ và thai nhi, ảnh hưởng của thai kỳ đối với quá trình lây nhiễm HBV, điều trị HBV trong thai kỳ và dự phòng lây truyền từ mẹ sang con.
Dự phòng lây truyền từ mẹ sang con là một thành phần quan trọng trong các nỗ lực toàn cầu nhằm giảm gánh nặng của HBV mạn tính vì lây truyền dọc là nguyên nhân chịu trách nhiệm cho khoảng một nửa số ca nhiễm HBV mạn tính trên toàn thế giới. Nguy cơ phát triển nhiễm HBV mạn tính tỷ lệ nghịch với tuổi tại thời điểm phơi nhiễm. Nguy cơ cao tới 90% ở những người bị phơi nhiễm trong khi sinh mà không được tiêm phòng vắc xin, trong khi nguy cơ thấp hơn nhiều (khoảng 20 đến 30%) ở những người bị phơi nhiễm trong thời thơ ấu. Các chương trình sàng lọc cho bà mẹ và tiêm chủng mở rộng cho trẻ nhỏ đã giảm đáng kể tỷ lệ lây truyền.
Chủ đề này sẽ xem xét những lưu ý đặc biệt đối với việc quản lý bệnh nhân nhiễm HBV cấp tính và mạn tính trong thời kỳ mang thai và hậu sản, cũng như dự phòng lây truyền từ mẹ sang con. Các bài tổng quan chủ đề bổ sung đề cập đến việc phòng ngừa và quản lý nhiễm HBV ở trẻ em và bệnh gan trong thai kỳ, được tìm thấy ở nơi khác:
- (See “Hepatitis B virus immunization in infants, children, and adolescents”.)
- (See “Hepatitis viruses and the newborn: Clinical manifestations and treatment”.)
- (See “Clinical manifestations and diagnosis of hepatitis B virus infection in children and
adolescents”and “Management of hepatitis B virus infection in children and adolescents”.) - (See “Acute fatty liver of pregnancy”.)
- (See “HELLP syndrome (hemolysis, elevated liver enzymes, and low platelets)”.)
- (See “Intrahepatic cholestasis of pregnancy”.)
- (See “Approach to liver disease occurring during pregnancy”.)
- (See “Pregnancy in women with pre-existing chronic liver disease”.)
2. Nhiễm vi-rút viêm gan B cấp tính
Viêm gan vi-rút cấp tính là nguyên nhân phổ biến nhất gây vàng da trong thai kỳ [ 1 1. Các nguyên nhân khác bao gồm các bệnh gan liên quan đến thai kỳ, như gan nhiễm mỡ cấp tính thai kỳ, hội chứng HELLP và ứ mật trong gan thai kỳ. (See “Approach to liver disease occurring during pregnancy”and “Acute fatty liver of pregnancy”and “HELLP syndrome (hemolysis, elevated liver enzymes, and low platelets)”and “Intrahepatic cholestasis of pregnancy”.)
Nhiễm vi-rút viêm gan B cấp tính (HBV) trong thai kỳ thường nhẹ và không liên quan đến tăng tỷ lệ tử vong hoặc gây quái thai [ 1,2 1. Vì vậy, nhiễm HBV trong thời kỳ mang thai không nên xem xét ngay đến việc chấm dứt thai kỳ. Tuy nhiên, đã có báo cáo về sự gia tăng tỷ lệ cân nặng khi sinh thấp và sinh non ở trẻ sinh ra từ mẹ nhiễm HBV cấp tính [ 2,3 1.
HBV cấp tính xảy ra trong giai đoạn đầu thai kỳ có liên quan đến tỷ lệ lây truyền chu sinh là 10% [ 3J. Tỷ lệ lây truyền tăng lên đáng kể nếu nhiễm trùng cấp tính xảy ra ở hoặc gần thời điểm sinh, với tỷ lệ cao tới 60% đã được báo cáo [ jj. Do đó, việc theo dõi nối tiếp nên được thực hiện trong suốt thai kỳ, và nếu mẹ vẫn dương tính với kháng nguyên bề mặt viêm gan B (HBsAg) hoặc có HBV DNA huyết thanh có thể phát hiện được, trẻ sơ sinh nên được tiêm globulin miễn dich viêm gan Bngoài liều vắc xin viêm gan B đầu tiên sau khi sinh. Liệu pháp kháng vi-rút để giảm tải lượng vi-rút cho mẹ cũng nên được xem xét nếu mẹ có nồng độ HBV DNA huyết thanh cao gần với thời điểm sinh. (See ‘Prevention of mother-to-child transmission1below.)
Điều trị nhiễm trùng cấp tính chủ yếu là hỗ trợ. Các xét nghiệm sinh hóa gan và thời gian prothrombin nên được theo dõi. Điều trị kháng vi-rút thường không cần thiết, ngoại trừ ở những phụ nữ bị suy gan cấp hoặc viêm gan nặng kéo dài [ 4 ]. (See “Hepatitis B virus : Overview of management”, section on ‘Acute infection’.)
Đối với những người bị nhiễm HBV cấp tính cần điều trị bằng thuốc kháng vi-rút, việc lựa chọn thuốc nào để sử dụng nên dựa vào thời gian điều trị dự kiến, khả năng tiếp cận và chi phí cho bệnh nhân. Tenofovir dỉsoproxíl fumarate(TDF) (300 mg mỗi ngày) hoặc lamivudine(100 mg mỗi ngày) đều là những lựa chọn phù hợp trong trường hợp này vì cả hai đều được sử dụng an toàn trong thai kỳ và nguy cơ phát triển kháng thuốc thấp vì thời gian điều trị dự kiến ngắn [ 5 1. Tuy nhiên, chúng tôi ưu tiên TDF hơn vì nguy cơ kháng thuốc thấp hơn. Dưới đây là phần thảo luận chi tiết hơn về tính an toàn của các thuốc kháng vi-rút để điều trị HBV trong thai kỳ. (See ‘Safety of antiviral agents in pregnancy’below.)
3. Nhiễm vi-rút viêm gan B mạn tính
Ảnh hưởng của thai kỳ đến lịch sử tự nhiên của HBV mạn tính – Mang thai thường được dung nạp tốt ở những phụ nữ nhiễm vi-rút viêm gan B (HBV) mạn tính mà không bị bệnh gan tiến triển. Tuy nhiên, mang thai được coi là một trạng thái dung nạp miễn dịch và có liên quan đến nồng độ corticosteroid cao của tuyến thượng thận có thể điều biến đáp ứng miễn dịch. Do đó, những biểu hiện lâm sàng sau đây có thể gặp ở phụ nữ mang thai nhiễm HBV mạn tính:
- Các đợt bùng phát viêm gan – Những thay đổi miễn dịch trong thời kỳ mang thai và hậu sản có liên quan đến các đợt bùng phát viêm gan (bao gồm cả tình trạng mất bù ở gan). Một đợt bùng phát nhiễm HBV thường được định nghĩa là sự gia tăng alanin aminotransferase (ALT) > 2-3 lần, cao hơn ít nhất 3-5 lần so với khoảng tham chiếu. Tuy nhiên, các đợt bùng phát với các hậu quả lâm sàng nghiêm trọng dường như là không phổ biến [ 6,7]. Trong một nghiên cứu tiến cứu theo dõi 126 phụ nữ trong thời kỳ mang thai và hậu sản, 2 bệnh nhân xuất hiện đợt bùng phát trong thai kỳ, trong khi đó 27 bệnh nhân (25%) xuất hiện đợt bùng phát trong thời kỳ hậu sản [ 7]. Trong thời kỳ hậu sản, các đợt bùng phát có thể liên quan đến sự phục hòi miễn dịch, một tình huống tương tự như các đợt bùng phát về mặt miễn dịch đã được mô tả sau khi ngừng dùng corticosteroid ở bệnh nhân HBV mạn tính không mang thai [ 8-10]. (See “Hepatitis B virus reactivation associated with immunosuppressive therapy”, section on ‘HBV flare’.)
Các yếu tố dự báo về đợt bùng phát HBV trong thai kỳ vẫn chưa được xác định. Tuy nhiên, các đợt bùng phát dường như phổ biến hơn ở những phụ nữ có kháng nguyên e viêm gan B (HBeAg) dương tính [ 7 1. Ngoài ra, các đợt bùng phát có liên quan đến sự chuyển đổi huyết thanh HBeAg ở khoảng 12 đến 17% bệnh nhân [ 8_], một tỷ lệ tương tự như những gì được mô tả ở những bệnh nhân không mang thai. Bằng chứng hạn chế cho thấy sự chuyển đổi huyết thanh không liên quan đến tuổi mẹ, số lần sinh, hoặc sự hiện diện của các đột biến precore hoặc basal core promotor [ 8,11]. (See “Hepatitis B virus : Clinical manifestations and natural history”, section on ‘Immune-active, HBeAq-neqative’.)
- Tiến triển của bệnh gan – Những thay đổi về miễn dịch, chuyển hóa và huyết động học xảy ra trong thời kỳ mang thai có khả năng làm trầm trọng thêm hoặc biểu hiện bệnh gan nền Mặc dù hầu hết bệnh nhân không được dự kiến tiến triển thành xơ gan trong thời gian ngắn, nhưng tình trạng mất bù có thể xảy ra trong trường hợp đợt bùng phát nặng.
Tuy nhiên, có thể khó đánh giá sự tiến triển của bệnh gan trong thai kỳ vì những thay đổi sinh lý bình thường có thể giống với các đặc điểm lâm sàng của bệnh gan mạn tính. Đặc biệt, albumin và hematocrit huyết thanh thường giảm, trong khi phosphatase kiềm và alpha fetoprotein tăng. Tương tự, khám thực thể có thể phát hiện các dấu hiệu đặc trưng gợi ý bệnh gan mạn tính như bàn tay son, phù chi dưới và sao mạch.
- HBV DNA – Những thay đổi về miễn dịch liên quan đến thai kỳ cũng có khả năng làm tăng lượng vi-rút HBV trong máu; tuy nhiên, hầu hết các nghiên cứu đều phát hiện ra rằng nồng độ HBV DNA vẫn ổn định trong thai kỳ [ 12,13 Ị.
Ảnh hưởng của HBV mạn tính đến kết cục thai kỳ – Đối với các bà mẹ bị HBV mạn tính, ảnh hưởng của nhiễm HBV đối với trẻ sơ sinh chưa được xác định rõ và dữ liệu còn mâu thuẫn [ 14- 21 1. Ví dụ, một nghiên cứu lớn so sánh 824 phụ nữ dương tính với kháng nguyên bề mặt (HBsAg) viêm gan B với 6281 người ở nhóm chứng âm tính với HBsAg [ 18 1. Không có sự khác biệt nào về tuổi thai khi sinh, cân nặng khi sinh, tỷ lệ sinh non, vàng da sơ sinh, dị tật bẩm sinh hoặc tử vong chu sinh. Tuy nhiên, các nghiên cứu khác đã phát hiện ra mối liên hệ có thể có giữa HBV mạn tính và đái tháo đường thai kỳ [ 14,15,19 1, tàng nguy cơ sinh non [ 20 1, cân nặng khi sinh thấp [ 21 1 và chảy máu trước sinh [19 1.
Phụ nữ bị xơ gan có nguy cơ đáng kể đối với các biến chứng chu sinh và kết cục kém của mẹ và thai nhi, bao gồm chậm tăng trưởng trong tử cung, nhiễm trùng trong tử cung, sinh non và thai chết trong tử cung. Nguy cơ gia tăng đã được chứng minh trong một nghiên cứu dựa trên dân số ở Canada, so sánh kết cục của mẹ và thai nhi ở 399 bệnh nhân bị xơ gan với một nhóm chứng phù hợp sinh từ năm 1993 đến năm 2005 [ 22]. Các biến chứng của mẹ bao gồm tăng huyết áp thai kỳ, nhau bong non, và chảy máu chu sản đều tăng ở nhóm bị xơ gan. Ngoài ra, 15% bà mẹ bị xơ gan phát triển thành xơ gan mất bù. Tỷ lệ tử vong chung cao hơn đáng kể so với nhóm chứng (1,8 so với 0 %). Trẻ có mẹ bị xơ gan cũng có tỷ lệ sinh non và chậm tăng trưởng cao hơn và tỷ lệ tử vong thai nhi cao hơn đáng kể (5,2 so với 2,1%). Các báo cáo khác đã mô tả sự gia tăng nguy cơ chảy máu do giãn vỡ tĩnh mạch, đặc biệt trong ba tháng cuối và trong khi chuyển dạ vì tăng áp lực trong ổ bụng và tăng thể tích huyết tương. (See “Pregnancy in women with pre¬existing chronic liver disease”, section on ‘Cirrhosis and portal hypertension’.)
Dưới đây là phần thảo luận về sự lây truyền từ mẹ sang con. (See ‘Mother-to-chỉld transmission’below.)
Các lưu ý khi quản lý – cần đánh giá nhiều yếu tố khác nhau khi quyết định quản lý thai phụ bị HBV mạn tính trong thai kỳ, bao gồm chỉ định điều trị, thời gian điều trị dự kiến, tác dụng bất lợi tiềm tàng đối với thai nhi, nguy cơ phát triển kháng thuốc, và khả năng tiếp cận và chỉ phí của các thuốc kháng vi-rút. Sức khỏe của mẹ và thai nhi phải được xem xét độc lập khi quyết định điều trị. Phụ nữ mang thai với HBV mạn tính nên được quản lý kết hợp với bác sĩ gan mật.
Phụ nữ đang mang thai – Một số phụ nữ bị HBV mạn tính cần liệu pháp kháng vi-rút để ngăn chặn sự tiến triển của bệnh gan (ví dụ, những người bị viêm gan hoạt động miễn dịch), trong khi những người khác có thể theo dõi.
- Bệnh nhân có thai trong khi đang điều trị thuốc kháng vi-rút – Phụ nữ nên thông báo cho bác sĩ lâm sàng ngay nếu họ có thai trong khi đang điều trị thuốc kháng vi-rút, và nên thảo luận về những nguy cơ và lợi ích khi tiếp tục điều trị. Tiếp tục điều trị có thể gây nguy cơ cho thai nhi trong khi ngừng điều trị có thể gây nguy cơ bùng phát viêm gan cho mẹ.
Ngừng điều trị có thể được xem xét ở phụ nữ không bị xơ gan nếu bệnh nhân đã đạt được mục tiêu điều trị (see “Hepatitis B virus : Overview of management”, section on ‘Duration and treatment endpoints’). Mặt khác, phụ nữ đang dùng entecavìr, adefovir, interferon hoặc tenofovir alafenamide(môt dạng bào chế của tenofovir đã được phê duyệt vào năm 2016) có thể tiếp tục điều trị bằng cách chuyển sang một thuốc thay thế, như tenofovir disoproxil fumarate(TDF), hiện có nhiều dữ liệu về tính an toàn hơn và dường như an toàn để sử dụng trong thai kỳ. Những phụ nữ này nên được theo dõi chặt chẽ trong giai đoạn chuyển tiếp để đảm bảo ức chế vi-rút. Dưới đây là phần thảo luận chi tiết hơn về tính an toàn của các thuốc kháng vi-rút trong thai kỳ. (See ‘Safety of antiviral agents in pregnancy’below.)
- Chỉ định liệu pháp kháng vi-rút – Quyết định bắt đầu điều trị khi đang mang thai phụ thuộc vào việc có hoặc không có xơ gan, HBeAg và kháng thể e viêm gan B (anti-HBe), cũng như nồng độ HBV DNA và aminotransferase [ 23]. (See “Hepatitis B virus : Overview of management”, section on ‘Indications for antiviral therapy’and “Hepatitis B virus : Overview of management”.)
Các chỉ định điều trị kháng vi-rút ở phụ nữ mang thai nhìn chung giống như đối với bệnh nhân không mang thai. Liệu pháp kháng vi-rút được khuyến cáo cho những bệnh nhân có ALT tăng dai dẳng > 2 lần giới hạn trên bình thường và HBV DNA tăng cao (HBV DNA > 20.000 đơn vị quốc tế/mL ở bệnh nhân HBeAg dương tính hoặc HBV DNA > 2000 đơn vị quốc tế/mL ở bệnh nhân HbeAg âm tính) (@ table 1). Tuy nhiên, ở phụ nữ mang thai không bị xơ gan, một số bệnh cảnh có thể khác nhau. Ví dụ:
- Một phụ nữ có thể lựa chọn trì hoãn điều trị cho đến sau khi sinh nếu cô ấy có bằng chứng về hoạt động bệnh nhẹ, như nòng độ aminotransferase chỉ ngay trên ngưỡng điều trị.
- Ngược lại, một phụ nữ có tải lượng vi-rút > 2 X 105 đơn vị quốc tế/mL nên bắt đầu điều trị trong ba tháng cuối ngay cả khi nồng độ aminotransferase bình thường. Trong trường hợp này, mục tiêu điều trị là ngăn ngừa lây truyền cho trẻ. (See ‘Maternal antiviral therapy to prevent transmission’below.)
TDF được ưu tiên sử dụng nếu dự định điều trị kháng vi-rút ở thai phụ vì hiệu lực, dữ liệu an toàn và nguy cơ kháng thuốc thấp. (See ‘Safety of antiviral agents in pregnancy’below and “Hepatitis B virus: Overview of management”, section on ‘Overview of antiviral agents’.)
Theo dõi phụ nữ không có chỉ định liệu pháp kháng vi-rút – Những phụ nữ không điều trị kháng vi-rút trong thai kỳ nên được theo dõi chặt chẽ để đánh giá đợt bùng phát (see ‘Impact of pregnancy on the natural history of chronic HBV’above):
- Chúng tôi thực hiện các xét nghiệm sinh hóa gan ba tháng một lần trong khi mang thai và cho đến sáu tháng sau khi sinh. Sau đó, việc theo dõi sẽ giống như đối với các bệnh nhân viêm gan B khác không cần điều trị kháng vi-rút, thường là sáu tháng một lần đối với bệnh nhân có HBeAg dương tính trong giai đoạn dung nạp miễn dịch và 6 đến 12 tháng một lần đối với những người được xác nhận là trong giai đoạn mang vi-rút không hoạt động (H table 2). (See “Hepatitis B virus : Overview of management”.)
- HBV DNA nên được xét nghiệm đồng thời hoặc khi có tăng ALT. Ngoài ra, HBV DNA nên được định lượng ở tuần thứ 26 đến 28 để xác định xem có nên điều trị thuốc kháng vi-rút để giảm nguy cơ lây truyền từ mẹ sang con hay không. (See ‘Maternal antiviral therapy to prevent transmission1below.)
Phụ nữ bị xơ gan – Quản lý xơ gan ở phụ nữ có thai không khác so với bệnh nhân không mang thai. Tầm soát giãn tĩnh mạch bằng nội soi vẫn được khuyến cáo và an toàn trong thai kỳ. Chảy máu do giãn vỡ tĩnh mạch đang diễn ra nên được quản lý theo cùng một cách với thắt tĩnh mạch. Chỉ định sử dụng thuốc chẹn beta để điều trị dự phòng hoặc quản lý chảy máu sau giãn vỡ tĩnh mạch cũng giống như ở những người không mang thai, nhưng dùng thuốc chẹn beta có liên quan đến sự gia tăng nhỏ nguy cơ chậm tăng trưởng trong tử cung, nhịp tim chậm ở thai nhi / trẻ sơ sinh, hạ đường huyết ở trẻ sơ sinh và / hoặc ức chế hô hấp ở trẻ sơ sinh. Octreotidekhông nên dùng trong khi quản lý chảy máu do giãn vỡ tĩnh mạch cấp tính vì nguy cơ thiếu máu cục bộ tử cung. Một cuộc thảo luận chi tiết hơn về việc quản lý thai phụ bị xơ gan được tìm thấy ở nơi khác. (See “Pregnancy ìn women with pre-existing chronic liver disease”, section on ‘Cirrhosis and portal hypertension’.)
Phụ nữ có khả năng sinh con – Chỉ định điều trị kháng vi-rút cũng giống như đối với bệnh nhân không có khả năng sinh đẻ. Chúng được quyết định bởi tình trạng HBeAg, mức HBV DNA, và mức độ hoạt động hoặc giai đoạn của bệnh gan. (See “Hepatitis B virus : Overview of management”.)
Tuy nhiên, có những cân nhắc quan trọng ở phụ nữ có khả năng sinh con:
- Những người bị bệnh gan nhẹ đang có kế hoạch thụ thai trong tương lai gần có thể trì hoãn điều trị và theo dõi cho đến khi họ sinh xong.
- Những người lựa chọn điều trị trước khi cố gắng mang thai có thể chọn interferon pegylated vì thời gian hữu hạn của nó (48 tuần), miễn là họ sử dụng biện pháp tránh thai trong khi điều trị. Tuy nhiên, nếu bệnh nhân chọn điều trị bằng nucleos(t)ide analogues thì TDF được ưu tiên hơn; thử nghiệm hạn chế ủng hộ tính an toàn của nó trong thai kỳ và nguy cơ kháng thuốc thấp. (See ‘Safety of antiviral agents in pregnancy’below.)
- Những bệnh nhân có thai khi đang điều trị nên liên hệ ngay với bác sĩ. Quản lý những bệnh nhân như vậy được mô tả ở trên. (See ‘Women who are pregnant’above.)
Cho con bú – Trẻ sơ sinh được tiêm globulin miễn dich viêm gan B(HBIG) và liều vắc xin viêm gan B đầu tiên sau khi sinh có thể được bú sữa mẹ [ 24,25 Ị. Tuy nhiên, điều quan trọng là trẻ sơ sinh phải hoàn thành loạt vắc-xin viêm gan B. Các bà mẹ bị viêm gan B mạn tính đang cho con bú cũng nên được chăm sóc để tránh chảy máu do nứt núm vú. Các bà mẹ mang vi-rút không nên tham gia hiến tặng sữa mẹ. Dưới đây là các thảo luận về việc cho con bú và lây truyền HBV và chủng ngừa cho trẻ sơ sinh. (See ‘Breastfeeding and transmission1below and ‘Newborn immunization’below.)
Đối với những phụ nữ bị HBV mạn tính tiếp tục điều trị kháng vi-rút sau khi sinh, dữ liệu an toàn về việc sử dụng liệu pháp kháng vi-rút HBV trong thời kỳ cho con bú là không rõ ràng. Do đó, những lợi ích của việc cho con bú và sự sẵn có của các biện pháp thay thế cho việc cho con bú, nên được thảo luận với những phụ nữ cần điều trị kháng vi-rút sau sinh. Quyết định cho con bú phải dựa trên sở thích của bệnh nhân.
Các nhãn thuốc thường khuyến cáo rằng nên tránh dùng nucleos(t)ide analogues trong thời kỳ cho con bú vì chúng được bài tiết vào sữa mẹ. Tuy nhiên, chỉ có nồng độ tenofovir thấp được phát hiện ở những phụ nữ dùng TDF [ 26-30 Ị, và chúng không có bất kỳ tác dụng sinh học nào đối với trẻ bú mẹ. Ví dụ, một nghiên cứu cho thấy liều lượng trong sữa mẹ trung bình từ các bà mẹ đang dùng TDF chiếm 0,03% liều lượng trẻ uống được đề xuất và nồng độ trong huyết tương trẻ sơ sinh mô phỏng là cực kỳ thấp [ 28 1. Ngoài ra, các báo cáo ca bệnh trẻ sinh ra từ mẹ bị HBV mạn tính không phát hiện bất kỳ tác dụng bất lợi ngắn hạn nào ở trẻ được bú sữa mẹ trong khi mẹ của chúng đang dùng TDF [ 31-34 1.
Dữ liệu từ phụ nữ nhiễm HIV cũng ủng hộ tính an toàn của liệu pháp kháng vi-rút trong thời kỳ cho con bú. Ví dụ, một nghiên cứu đánh giá tenofovir và emtricitabine trong sữa mẹ của 5 phụ nữ nhiễm HIV ở châu Phi cho thấy lượng tenofovir và emtricitabine nuốt vào trung bình khi cho con bú sẽ tương ứng là 0,03 và 2% so với liều lượng trẻ uống được đề xuất [ 28 1. Các cuộc thảo luận bổ sung về việc cho con bú ở bệnh nhân nhiễm HIV được tìm thấy ở nơi khác (See “Prevention of HIV transmission during breastfeeding in resource-limited settings”and “Antiretroviral selection and management in pregnant women with HIV in resource-rich settings”.)
4. Lây truyền từ mẹ sang con
Nguy cơ lây truyền – Nguy cơ lây truyền từ mẹ sang con của vi-rút viêm gan B (HBV) từ những bà mẹ dương tính với kháng nguyên bề mặt viêm gan B (HBsAg) sang con của họ đã được báo cáo là lên tới 90% nếu không sử dụng các biện pháp tiêm chủng thụ động và chủ động [ 35 1. Lây truyền có thể xảy ra trong tử cung, trong khi sinh hoặc sau khi sinh. (See ‘Risk factors for transmission’below and ‘Prevention of mother-to-child transmission’below.)
Tuy nhiên, nguy cơ lây truyền HBV đã giảm đáng kể khi áp dụng sàng lọc HBV cho tất cả bà mẹ, tiêm phòng vắc-xin viêm gan B cho tất cả trẻ sơ sinh và sử dụng globulin miễn dich viêm gan B (HBIG) dự phòng cho con của các bà mẹ có HBsAg dương tính. Ví dụ, nhiễm HBV chu sinh xảy ra ở 1,1% trẻ sơ sinh trong một nghiên cứu thuần tập đánh giá 9252 trẻ sinh ra từ những bà mẹ có HBsAg dương tính ở Hoa Kỳ [ 36]. Khoảng 95 % trẻ được tiêm vắc xin viêm gan B và HBIG trong vòng 12 giờ sau khi sinh, và hầu hết tất cả đều hoàn thành > 3 liều của loạt vắc-xin viêm gan B. Sự lây truyền có liên quan đáng kể khi có mẹ dương tính với kháng nguyên e viêm gan B (HBeAg), có tải lượng vi-rút HBV > 2000 đơn vị quốc tế/mL, hoặc < 25 tuổi; sự lây truyền cũng liên quan đến việc nhận < 3 liều vắc-xin viêm gan B. Trong nghiên cứu này, mối liên quan giữa tuổi mẹ trẻ hơn và sự lây truyền HBV có thể liên quan đến tình trạng HBeAg của mẹ và tải lượng vi-rút, vì những phụ nữ trẻ hơn trong nhóm thuần tập thường có HBeAg dương tính hơn với mức HBV DNA cao hơn, phù hợp với giai đoạn dung nạp miễn dịch so với phụ nữ lớn tuổi.
Hiệu quả bảo vệ cao của tiêm chủng vắc xin cho trẻ sơ sinh gợi ý rằng hầu hết các nhiễm trùng xảy ra trong khi sinh khi dịch tiết và máu của mẹ trong ống đẻ tiếp xúc với niêm mạc của trẻ sơ sinh. Để hỗ trợ giả thuyết này, một nghiên cứu được thực hiện ở Trung Quốc cho thấy chỉ có 3,7% trẻ có kết quả xét nghiệm HBsAg dương tính trong khi sinh đã bị nhiễm HBV do lây truyền trong tử cung [ 37 1.
Các yếu tố nguy cơ lây truyền – Các yếu tố nguy cơ quan trọng nhất đối với sự lây truyền từ mẹ sang con, mặc dù đã được điều trị dự phòng đúng cách (HBIG và liều vắc xin viêm gan B đầu tiên được tiêm trong vòng 12 giờ sau khi sinh, và đã hoàn thành loạt vắc xin viêm gan B), dường như là HBeAg dương tính và / hoặc mức HBV DNA cao ở mẹ.
Lây truyền qua nhau thai và lây truyền do các thủ thuật sản khoa là những nguyên nhân ít gặp, và cho con bú dường như không gây ra nguy cơ đáng kể. Ngoài ra, lợi ích của sinh mổ trong việc bảo vệ chống lại sự lây truyền vẫn chưa được xác định rõ ràng. Do đó, cách tiếp cận sản khoa không nên bị ảnh hưởng bởi tình trạng HBV của mẹ.
Tình trạng nhân lên của HBV – Nguy cơ lây truyền tăng lên ở những phụ nữ có HBeAg dương tính và / hoặc có mức HBV DNA cao. Trong một loạt ca bệnh, sự lây truyền xảy ra trong trường hợp không có biện pháp dự phòng ở 85 đến 90% trẻ sinh ra từ mẹ có HBeAg dương tính và 32% trẻ sinh ra từ mẹ có HBeAg âm tính [ 38 1. Trẻ sinh ra từ những bà mẹ có HBeAg dương tính vẫn có nguy cơ nhiễm HBV, ngay cả khi chúng được tiêm vắc xin viêm gan B và HBIG (khoảng 9% trong một nghiên cứu thuần tập lớn) [ 39 1. Mô tả về các giai đoạn nhân lên của nhiễm HBV mạn tính được tìm thấy ở nơi khác. (See “Hepatitis B virus : Clinical manifestations and natural history”, section on ‘Phases of chronic HBV infection’.)
Nồng độ HBV DNA – Nồng độ HBV DNA trong huyết thanh mẹ tương quan với nguy cơ lây truyền. Sự lây truyền dọc của viêm gan B xảy ra ở 9 đến 39 % trẻ sơ sinh của các bà mẹ có lượng vi-rút cao trong máu mặc dù đã được tiêm vắc xin sau khi sinh [40-43]. Nguy cơ lây truyền HBV là hiếm khi HBV DNA của mẹ <105 đến 106 đơn vị quốc tế/mL. Ví dụ:
- Trong một nghiên cứu trên 773 bà mẹ có HBsAg dương tính ở Đài Loan, tỷ số chênh khi có con bị nhiễm bệnh tăng từ 1 lên 147 khỉ nồng độ HBV DNA trong huyết thanh mẹ tăng từ 5 pg/mL (khoảng 150.000 đơn vị quốc tế/mL) đến > 1400 pg/mL (khoảng 45.000.000 đơn vị quốc tế/mL) [ 44 Ị.
- Trong một nghiên cứu khác được thực hiện ở Trung Quốc bao gồm 112 trẻ sơ sinh của những bà mẹ bị nhiễm HBV mạn tính, tỷ lệ lây nhiễm tăng từ 0% ở những bà mẹ có nồng độ HBV DNA trong huyết thanh < 20.000 đơn vị quốc tế/mL (< 105 copies/mL) lên 50% ở những bà mẹ có nồng độ HBV DNA khoảng 109 đơn vị quốc tế/mL (từ 9 đến 10 logio copies/mL) [ 45J.
- Một nghiên cứu được thực hiện ở úc bao gồm 138 trẻ được sinh ra từ các bà mẹ có HBV DNA dương tính cho thấy một xu hướng tương tự [ 46 Ị. Sự lây truyền HBV đã được phát hiện ở bốn trẻ mặc dù đã sử dụng vắc xin viêm gan B và HBIG cho ba trẻ và chỉ sử dụng vắc xin cho một trẻ. Cả 4 đứa trẻ đều được sinh ra từ những bà mẹ có nồng độ HBV DNA cao (> 108 copies/mL).
- Một nghiên cứu quan sát tiến cứu theo dõi 303 cặp mẹ – con trong đó mẹ có HBsAg dương tính [ 47 1. Nhiễm HBV mạn tính phát triển ở 10 trẻ được sinh ra từ 87 bà mẹ có HBeAg dương tính trong khi đó không có trẻ nào được sinh ra từ 216 bà mẹ có HBeAg âm tính bị nhiễm HBV. Tất cả trẻ sinh ra từ những bà mẹ có HBeAg dương tính đều được tiêm một liều vắc xin viêm gan B trong tuần đầu tiên và HBIG trong vòng 24 giờ sau khi sinh. Mô hình hồi quy logistic đa biến dự đoán tỷ lệ nhiễm HBV lây truyền qua mẹ ở các mức HBV DNA là 2 X 1 o4, 2 X 105, 2 X 106, 2 X 107 và 2 X 108 đơn vị quốc tế/mL tương ứng là 0,9% (Cl 95%, 0,9-2,7%), 2,6% (Cl 95%, 1,1-6,2%), 6,6% (Cl 95%, 0,5-12,6%), 14,6% (95% Cl, 5,6-23,6 %) và 27,7 % (95% Cl, 13,1-42,4 %).
- Một nghiên cứu quan sát đánh giá 4446 trẻ sinh ra từ 3253 bà mẹ dương tính với HBV từ năm 1997 đến năm 2010 [ 48 Ị. Phần lớn trẻ được tiêm HBIG và ba liều vắc-xin viêm gan B. Lây truyền từ mẹ sang con xảy ra ở 3,4% các ca sinh từ các bà mẹ có HBeAg dương tính và 0,04% các ca sinh từ các bà mẹ có HBeAg âm tính. Có 835 phụ nữ được xét nghiệm HBV DNA và HBeAg. Trong số những phụ nữ đó, ba trẻ bị nhiễm HBV mặc dù đã được tiêm chủng thụ động và chủ động. Cả ba đứa trẻ đều được sinh ra từ những bà mẹ có HBeAg dương tính và có mức HBV DNA > 6 X 107 đơn vị quốc tế/mL. Không có sự lây truyền HBV nào xảy ra ở những bà mẹ có tải lượng vi-rút < 5 X 107 đơn vị quốc tế/mL, bất kể tình trạng HBeAg của mẹ.
Lây truyền qua nhau thai – Lây truyền qua nhau thai dường như chỉ gây ra một số ít bệnh nhiễm trùng. Nó có thể xảy ra do rỉ ối, như trong khi dọa sảy thai[ 49,50 1. HBV đã được tìm thấy trong các tế bào nội mô mao mạch nhung mao và các nguyên bào nuôi nhau thai [ 37,51 1. Điều này ủng hộ giả thuyết cho rằng sự phá vỡ hàng rào nhau thai là một cơ chế có thể gây nhiễm trùng trong tử cung. Do đó, khi xảy ra chuyển dạ sinh non hoặc sảy thai tự nhiên, máu mẹ và thai nhi có thể bị trộn lẫn, dẫn đến lây truyền HBV [ 49 1. Một nghiên cứu cho thấy HBV có thể di chuyển qua nhau thai từ mẹ sang nguyên bào nuôi của thai nhi [ 52]. Nguyên nhân gây nhiễm trùng nhau thai không rõ ràng. Tải lượng vi-rút của mẹ cao và chuyển dạ sinh non được coi là các yếu tố nguy cơ, nhưng độ mạnh của các mối liên quan này thì không chắc chắn [ 37,45 Ị.
Chọc ối và các thủ thuật khác – Chọc ối chẩn đoán, nếu có chỉ định lâm sàng, không nên bỏ qua. Lây truyền sau chọc ối đã được mô tả, nhưng nguy cơ dường như thấp [ 53], đặc biệt nếu người mẹ có HBeAg âm tính với tải lượng vi-rút HBV thấp và thủ thuật được thực hiện bằng kim 22 gauge dưới sự hướng dẫn liên tục của siêu âm [ 54,551. (See “Diagnostic amniocentesis”.) Trong một nghiên cứu minh họa, những phụ nữ bị HBV được chọc ối có tỷ lệ lây truyền dọc không khác biệt đáng kể so với những phụ nữ nhiễm HBV không chọc ối (9 so với 11%) [ 56 1. Ảnh hưởng của các thủ thuật xâm lấn khác trong thời kỳ mang thai (ví dụ, sinh thiết gai nhau, lấy mẫu máu dây rốn qua da, phẫu thuật bào thai) đối với nguy cơ lây truyền chưa được biết rõ.
Vỡ ối non thiếu tháng – Có rất ít dữ liệu khảo sát tình trạng vỡ ối non thiếu tháng như là một yếu tố nguy cơ lây truyền HBV, và các dữ liệu hiện có còn mâu thuẫn [ 57,58 1. Do đó, quản lý những bệnh nhân như vậy không có sự khác biệt so với những phụ nữ bị HBV mạn tính mà không bị vỡ ối non thiếu tháng.
Sinh mổ – Lợi ích của sinh mổ trong việc bảo vệ chống lây truyền HBV chưa được xác định rõ ràng trong các thử nghiệm có đối chứng được tiến hành tốt [ 59-61 1. Vì vậy, sinh mổ không nên được khuyến cáo thường quy cho các bà mẹ bị HBV với mục đích giảm lây truyền HBV [ 24,62 Ị.
Cho con bú và sự lây truyền – Lây truyền HBV qua việc cho con bú là khó có thể xảy ra, đặc biệt là ở những trẻ được tiêm vắc xin viêm gan B và HBIG sau khi sinh. Mặc dù HBV DNA đã được phát hiện trong sữa non của những bà mẹ có HBsAg dương tính, một nghiên cứu trên 147 trẻ sinh ra từ những bà mẹ bị HBV cho thấy không có bằng chứng về mối liên hệ giữa việc cho con bú và sự phát triển nhiễm HBV mạn tính sau đó ở trẻ [ 63 Ị. Trong một nghiên cứu khác bao gồm 369 trẻ sơ sinh được sinh ra từ các bà mẹ bị nhiễm HBV mạn tính, tất cả đều được nhận và hoàn thành chương trình dự phòng miễn dịch HBV, không có trẻ nào trong số 101 trẻ bú mẹ và 9 trẻ ăn sữa công thức dương tính với HBsAg [ 64 Ị. Một cuộc thảo luận bổ sung về việc cho con bú được tìm thấy ở trên. (See ‘Breastfeeding’above.)
Phòng ngừa lây truyền từ mẹ sang con – Phòng ngừa lây truyền từ mẹ sang con bao gồm sàng lọc phụ nữ mang thai, sử dụng liệu pháp kháng vi-rút cho phụ nữ có nồng độ HBV DNA cao và thực hiện tiêm chủng chủ động – thụ động cho trẻ sơ sinh mà mẹ có HBsAg dương tính (ố&algorithm 1).
Sàng lọc mẹ – Nên thực hiện xét nghiệm HBsAg cho tất cả phụ nữ trong lần khám tiền sản đầu tiên. Xét nghiệm máu này sẽ xác định xem một phụ nữ có bị nhiễm HBV hiện tại và có nguy cơ truyền HBV cho trẻ hay không.
- Những phụ nữ có HBsAg dương tính nên làm thêm xét nghiệm để đo nồng độ HBeAg, kháng thể e viêm gan B (anti-HBe), HBV DNA và aminotransferase ban đầu. Những phụ nữ có HBV DNA cao (tức là > 2 X 105 đơn vị quốc tế/mL hoặc > 106 copies/mL), nồng độ aminotransferase tăng cao và / hoặc HBeAg dương tính nên được chuyển đến bác sĩ gan mật để xem liệu có cần bắt đầu sớm thuốc kháng vi-rút hay không (see ‘Management considerations’above). Ngoài ra, cần đánh giá tình trạng HBV của bất kỳ trẻ lớn nào.
Những phụ nữ có nồng độ HBV DNA thấp trong ba tháng đầu nên làm lại xét nghiệm tải lượng vi-rút HBV vào khoảng tuần từ 26 đến 28. Nếu nồng độ này tăng lên, liệu pháp kháng vi-rút nên được xem xét (See ‘Maternal antiviral therapy to prevent transmission’below.)
- Phụ nữ có HBsAg âm tính và có nguy cơ nhiễm HBV cao (ví dụ: sử dụng ma túy dạng tiêm, có bạn tình hoặc tiếp xúc trong gia đình với người bị HBV mạn tính, có nhiều hơn một bạn tình trong sáu tháng trước đó, đã được đánh giá hoặc điều trị bệnh lây truyền qua đường tình dục (STI)) nên được xét nghiệm kháng thể bề mặt viêm gan B (anti-HBs) và kháng thể lõi viêm gan B (anti-HBc).
Những bà mẹ không có bằng chứng nhiễm hoặc phơi nhiễm với HBV trước đó (âm tính với anti-HBs và anti-HBc) nên được tiêm vắc xin [ 23 1. Ngoài ra, những phụ nữ như vậy nên xét nghiệm lại HBsAg vào cuối thai kỳ (khoảng 28 tuần). Một liều vắc-xin tăng cường cũng có thể là hợp lý cho những bệnh nhân chỉ có anti-HBc dương tính để xem liệu hiệu giá của anti-HBs có thể tàng lên > 10 mill đơn vị quốc tế/mL hay không. Tuy nhiên, ý nghĩa lâm sàng của điều này thì không rõ ràng. (See “Hepatitis B virus : Screening and diagnosis”, section on ‘Who should be tested’.)
Những phụ nữ không được xét nghiệm trước sinh nên được xét nghiệm tại thời điểm nhập viện để sinh [ 65 1.
Liệu pháp kháng vi-rút cho mẹ để ngăn ngừa lây truyền – Đối với phụ nữ mang thai có HBsAg dương tính không có chỉ định điều trị HBV dựa vào các thông số HBV (see ‘Management considerations’above), chúng tôi kiểm tra lại nồng độ HBV DNA khi thai được 26 đến 28 tuần và khuyến cáo liệu pháp kháng vi-rút ở tuần thứ 28 đến 30 ở những người có mức HBV DNA > 2 X 105 đơn vị quốc tế/mL hoặc > 106 copies/mL. Liệu pháp kháng vi-rút nên được dùng cùng với việc tiêm chủng chủ động – thụ động tiêu chuẩn cho trẻ để giảm hơn nữa nguy cơ lây truyền từ mẹ sang con ( algorithm 1). Ngưỡng nồng độ HBV DNA được dựa trên sự gia tăng nguy cơ lây truyền ở những tải lượng vi-rút cao này mặc dù đã tiêm vắc xin sau sinh. (See ‘HBV DNA level’above.)
Chúng tôi bắt đầu điều trị vào đầu tam cá nguyệt thứ ba để mà có đủ thời gian làm giảm tải lượng vi-rút HBV, ngay cả khi bệnh nhân sinh non. Đối với phụ nữ bắt đầu điều trị trước 32 tuần, chúng tôi thường kiểm tra nồng độ HBV DNA khoảng bốn tuần sau khi bắt đầu điều trị. Theo kinh nghiệm của chúng tôi, những bệnh nhân đang dùng thuốc hầu như luôn có mức HBV DNA giảm ít nhất từ 2 đến 3 log. Nếu tải lượng vi-rút không giảm, chúng tôi đánh giá các rào cản tiềm ẩn đối với việc tuân thủ dùng thuốc.
Đối với những người cần điều trị, chúng tôi ưu tiên tenofovir disoproxil fumarate(TDF) hơn là các thuốc kháng vi-rút khác vì rất hiếm khi gặp tình trạng kháng thuốc với TDF. Điều này rất quan trọng vì nhiều người trong số những bà mẹ trẻ này có thể cần điều trị kháng vi-rút cho bệnh gan của họ trong tương lai. Ngoài ra, thuốc này dường như an toàn để sử dụng trong thai kỳ và đã được đánh giá trong một số thử nghiệm lâm sàng tiến cứu [ 66-68 Ị. Dạng bào chế tenofovir mới hơn, tenofovir alafenamide■ Mặc dù thuốc này có ít độc tính trên xương và thận hơn so với TDF, tại thời điểm này, chúng tôi không sử dụng tenofovir alafenamide trong thai kỳ do không đủ dữ liệu về tính an toàn. Tính an toàn của các thuốc kháng vi-rút trong thai kỳ được xem xét chi tiết hơn dưới đây. (See ‘Safety of antiviral agents in pregnancy’below.)
Mặc dù các thuốc khác (ví dụ: lamivudìne, telbivudine) cũng làm giảm lây truyền từ mẹ sang con và dường như an toàn khi dùng trong thai kỳ [ 66,69-72 1, chúng có liên quan đến tỷ lệ kháng thuốc kháng vi-rút cao. Lamivudine có thể là một lựa chọn thay thế hợp lý nếu chi phí là rào cản đối với việc điều trị bằng thuốc kháng vi-rút và điều trị sẽ được thực hiện trong một thời gian ngắn (tức là, < 3 tháng). Tuy nhiên, điều quan trọng là bệnh nhân chưa từng dùng lamivudine trong quá khứ, vì những bệnh nhân này có nguy cơ nhiễm vi-rút kháng lamivudine.
Phụ nữ bắt đầu liệu pháp kháng vi-rút trong khi mang thai với mục đích duy nhất là ngăn ngừa lây truyền từ mẹ sang con có thể ngừng điều trị kháng vi-rút ngay sau khi sinh, đặc biệt nếu họ muốn cho con bú. Một số chuyên gia muốn tiếp tục điều trị từ 4 đến 12 tuần sau khi sinh, một phần để giảm nguy cơ bùng phát sau sinh [ 73 Ị. Tuy nhiên, trong một nghiên cứu tiến cứu với 91 phụ nữ (101 thai kỳ) được nhận liệu pháp kháng vi-rút để ngăn ngừa lây truyền, việc kéo dài liệu pháp kháng vi-rút sau khi sinh dường như không làm giảm tần suất bùng phát HBV trong thời gian theo dõi trung bình 48 tuần [ 74 1.
Bất kể liệu pháp kháng vi-rút được ngừng khi nào, phụ nữ nên được theo dõi sự bùng phát HBV bằng cách đo nồng độ ALT mỗi 3 tháng trong sáu tháng sau khi ngừng điều trị. Đối với những người tiếp tục liệu pháp kháng vi-rút sau khi sinh (ví dụ, để điều trị HBV mạn tính), những nguy cơ và lợi ích của việc cho con bú phải được thảo luận với người mẹ. (See ‘Breastfeeding’above and ‘Breastfeeding and transmission’above and “Hepatitis B virus : Overview of management”, section on ‘Indications for antiviral therapy’and “Hepatitis B virus : Overview of management”, section on ‘Overview of antiviral agents’.)
Cách tiếp cận của chúng tôi phù hợp với các khuyến cáo của American Association for the study of Liver Disease, National Academies of Sciences, Engineering, and Medicine, and the Advisory Committee on Immunization Practices [ 23,65,751.
Dữ liệu từ các thử nghiệm lâm sàng và nghiên cứu tiến cứu ủng hộ dùng liệu pháp kháng vi- rút cho mẹ để giảm lây truyền HBV bao gồm:
- Một phân tích gộp 26 nghiên cứu, bao gồm 3622 phụ nữ mang thai, cho thấy rằng liệu pháp kháng vi-rút (ngoài việc tiêm chủng chủ động và thụ động cho trẻ sơ sinh) làm giảm đáng kể sự lây truyền HBV ở trẻ sơ sinh, bằng chứng là giảm nguy cơ HBsAg dương tính trong huyết thanh (risk ratio 0,3; Cl 95% 0,2-0,4) và giảm nguy cơ HBV DNA dương tính trong huyết thanh trẻ (risk ratio 0,3; Cl 95% 0,2-0,5) [ 67 1. Ngoài ra, trong số các bà mẹ được điều trị bằng thuốc kháng vi-rút và trẻ sơ sinh của họ, không có sự gia tăng nguy cơ các kết cục bất lợi (ví dụ, dị tật bẩm sinh, sinh non, băng huyết sau sinh). Tuy nhiên, có những lo ngại về chất lượng của dữ liệu trong phân tích này do số lượng biến cố nhỏ và dữ liệu hạn chế về tính an toàn của các thuốc kháng vi-rút ở trẻ sơ sinh.
- Một thử nghiệm ngẫu nhiên trên 200 phụ nữ mang thai từ Trung Quốc có HBeAg dương tính và HBV DNA > 2 X 105 đơn vị quốc tế/mL (trung bình 108 đơn vị quốc tế/mL) lúc ban đầu nhận TDF (300 mg) hoặc giả dược, bắt đầu từ 30 đến 32 tuần tuổi thai và tiếp tục 4 tuần sau sinh [ 68]. Tất cả trẻ sơ sinh được dự phòng miễn dịch tiêu chuẩn bằng cách sử dụng HBIG và vắc-xin viêm gan B. ở tuần thứ 28 sau sinh, tỷ lệ lây truyền từ mẹ sang con thấp hơn đáng kể ở trẻ sinh ra từ những phụ nữ được điều trị bằng tenofovir so với những phụ nữ không được điều trị (5 so với 18%). Trong số 92 bà mẹ được điều trị tenofovir và hoàn thành thử nghiệm, không có trường hợp nào lây truyền HBV. Ngoài ra, nhận thấy không có sự khác biệt đáng kể về tỷ lệ dị tật bẩm sinh giữa trẻ được sinh ra từ các bà mẹ được điều trị và không được điều trị (2,1 so với 1,1%). Sau khi ngừng điều trị, nhiều bà mẹ được dùng tenofovir có sự gia tàng nồng độ alanin aminotransferase, nhưng không có bà mẹ nào bị bùng phát nặng hoặc mất bù ở gan.
- Hiệu quả của tenofovir trong việc làm giảm lây truyền từ mẹ sang con cũng được chứng minh trong một nghiên cứu tiến cứu trên 118 phụ nữ mang thai có HBV DNA > 1 o7’5 đơn vị quốc tế/mL và dương tính với HBsAg và HBeAg [ 66 ]■ Phụ nữ được dùng tenofovir (300 mg mỗi ngày), bắt đầu từ tuần 30 đến 32 của thai kỳ, hoặc không dùng liệu pháp kháng vi-rút, và tiếp tục điều trị trong một tháng sau khi sinh. Tất cả trẻ sơ sinh đều được tiêm chủng thụ động và chủ động. Trẻ sơ sinh được sinh ra từ những bà mẹ dùng tenofovir có tỷ lệ dương tính với HBsAg thấp hơn đáng kể lúc sáu tháng (1,5 so với 10,7%).
Các kết quả mâu thuẫn được phát hiện trong một thử nghiệm ngẫu nhiên ở Thái Lan đánh giá việc dùng TDF cho mẹ ở 331 phụ nữ mang thai bị HBV mạn tính và tải lượng vi-rút HBV trung bình là 108 đơn vị quốc tế/mL. Trong thử nghiệm này, các bà mẹ bắt đầu dùng TDF hoặc giả dược ở tuần 28 và tiếp tục điều trị trong hai tháng sau sinh [ 76]. Tất cả trẻ sơ sinh đều được nhận HBIG và vắc xin viêm gan B sau khi sinh, và sau đó dùng thêm bốn liều vắc xin viêm gan B lúc một, hai, bốn và sáu tháng. Trong số những phụ nữ đã hoàn thành nghiên cứu (147 người ở mỗi nhóm), không có sự khác biệt về tỷ lệ lây truyền (0 so với 2%, không có ý nghĩa). Khoảng 10 % bệnh nhân trong mỗi nhóm bị mất liên lạc; tuy nhiên, cũng thu được các kết quả tương tự nếu tình trạng lây nhiễm có sẵn cuối cùng được đưa vào phân tích hoặc phân tích được thực hiện với dữ liệu bị thiếu được coi là lây nhiễm.
Mặc dù TDF không chứng minh được lợi ích rõ ràng trong thử nghiệm này, nhưng những phát hiện này không làm thay đổi cách tiếp cận của chúng tôi đối với liệu pháp kháng vi-rút cho mẹ vì khả năng tổng quát hóa bị hạn chế. Ví dụ, việc tuân thủ quy trình điều trị dự phòng miễn dịch cho trẻ sơ sinh trong thử nghiệm này có thể không giống nhau ở các cơ sở khác nhau. HBIG và vắc- xin liều sau khi sinh không có sẵn ở nhiều quốc gia mặc dù đã được Tổ chức Y tế Thế giới khuyến cáo [ 77 Ị. Ngay cả ở các quốc gia có chương trình tiêm chủng vắc xin HBV liều sơ sinh, như Hoa Kỳ, thời điểm tiêm vắc xin HBV được khuyến cáo là trong vòng 12 giờ sau khi sinh [ 65J và chỉ có 71,1% trẻ được tiêm vắc xin HBV liều sơ sinh lúc ba ngày tuổi. [ 78]. Ngoài ra, trẻ nhỏ trong nghiên cứu này được tiêm bốn liều vắc-xin HBV trước khi đánh giá tình trạng nhiễm HBV lúc sáu tháng, trong khi hầu hết các hướng dẫn khuyến cáo chỉ tiêm hai đến ba liều trước sáu tháng (@table 3A)■ Kết quả của nghiên cứu này không bác bỏ khuyến cáo hiện tại về việc điều trị kháng vi-rút cho các bà mẹ có lượng vi-rút trong máu cao, nhưng gợi ý rằng có thể cần thêm các nghiên cứu về phác đồ tiêm chủng sau phơi nhiễm.
Tiêm chủng cho trẻ sơ sinh – Trẻ sơ sinh của những bà mẹ có kết quả xét nghiệm HBsAg dương tính nên được tiêm chủng chủ động – thụ động, với liều đầu tiên của loạt vắc xin viêm gan B và một liều HBIG được tiêm trong vòng 12 giờ sau khi sinh ở các vị trí khác nhau (B table 3A- B_). Sau đó, trẻ nên hoàn thành loạt vắc-xin viêm gan B. Một cuộc thảo luận chi tiết hơn về việc tiêm chủng HBV ở trẻ sinh ra từ những bà mẹ có HBsAg dương tính được tìm thấy ở nơi khác. (See “Hepatitis B virus immunization in infants, children, and adolescents”, section on ‘HBsAg- positive mother or mother with other evidence of HBV infection’.)
5. Tính an toàn của các thuốc kháng vi-rút trong thai kỳ
Tổng quan – Các lựa chọn trị liệu để điều trị vi-rút viêm gan B mạn tính (HBV) ở phụ nữ không mang thai bao gồm các nucleos(t)ide analogue đường uống và interferon pegyl hóa. Tuy nhiên, đối với phụ nữ có thai, nên tránh dùng interferon vì lo ngại gây sảy thai (See “Hepatitis B virus : Overview of management”, section on ‘Antiviral therapy’and ‘Other potential adverse events’below.)
Một số nucleos(t)id dường như an toàn (ví dụ: tenofovir disoproxil fumarateiTDFl), mặc dù không có thuốc HBV nào được US Food and Drug Administration (FDA) chấp thuận để sử dụng trong thai kỳ vì không có nghiên cứu lớn nào đề cập đến tính an toàn của liệu pháp kháng vi-rút ở phụ nữ chỉ bị nhiễm HBV trong thai kỳ. Hầu hết dữ liệu về tính an toàn là từ những bệnh nhân nhiễm HIV sử dụng phác đồ kháng vi-rút kết hợp [ 73 Ị. (See “Safety and dosing of antiretroviral medications in pregnancy”, section on ‘Lamivudine’and “Safety and dosing of antiretroviral medications in pregnancy”, section on ‘Tenofovir’.)
Nguy cơ gây quái thai – Hiện có rất ít dữ liệu trên người về nguy cơ gây quái thai của các thuốc kháng vi-rút được sử dụng để điều trị HBV [ 66,67,69-72,80 Ị. Dữ liệu trên người và động vật hiện có không tìm thấy bằng chứng về khả năng gây quái thai đối với TDF và telbìvudine.
Các nghiên cứu trên người cũng ủng hộ tính an toàn của lamivudinetrong thai kỳ, mặc dù các biến cố bất lợi đã được quan sát thấy trong một số nghiên cứu trên động vật. Có ít dữ liệu về tính an toàn hơn đối với tenofovir alafenamide, entecavìr, hoặc adefovirtrong thai kỳ; do đó, không thể loại trừ nguy cơ gây quái thai.
Năm 1989, Antiretroviral Pregnancy Registry ( www.apregistry.com) được thành lập để đánh giá tác động gây quái thai tiềm tàng của các thuốc kháng HIV. Năm 2003, cơ quan đăng ký cũng bắt đầu thu thập dữ liệu về việc phơi nhiễm với các thuốc kháng HBV. Thông tin cung cấp cho cơ quan đăng ký có nguồn gốc từ các nghiên cứu lâm sàng và các báo cáo hồi cứu về việc phơi nhiễm với thuốc kháng vi-rút. Dữ liệu từ cơ quan đăng ký cho thấy phần trăm trẻ sơ sinh bị dị tật bẩm sinh được sinh ra từ phụ nữ nhiễm HIV và / hoặc HBV phơi nhiễm với các thuốc kháng vi- rút không > 3% tỷ lệ dị tật bẩm sinh được phát hiện trong dân số chung ở Hoa Kỳ [ 81,82]. Như ví dụ:
- Tenofovir disoproxil fumarate- 2,3% (85 trong số 3715) trẻ sinh ra từ những bà mẹ dùng tenofovir disoproxil fumarate (TDF) trong ba tháng đầu phát triển dị tật bẩm sinh và 2,2% (36 trên 1614) trẻ sinh ra từ những bà mẹ dùng TDF trong quý hai và quý ba của thai kỳ phát triển dị tật bẩm sinh.
- Lamivudine- 3% (154 trong số 5069) trẻ sinh ra từ những bà mẹ dùng lamivudine trong ba tháng đầu thai kỳ phát triển dị tật bẩm sinh và 2,9% (211 trên 7369) trẻ sinh ra từ những bà mẹ dùng lamivudine trong quý hai và quý ba của thai kỳ phát triển dị tật bẩm sinh.
- Các thuốc khác – Đối với entecavir, chỉ có 80 trẻ sơ sinh được báo cáo là bị phơi nhiễm trong ba tháng đầu và chỉ có hai trẻ trong quý hai và quý ba của thai kỳ, chỉ có hai trẻ bị dị tật bẩm sinh được báo cáo trong nhóm ba tháng đầu. Đối với adefovir, chỉ có 82 trẻ sơ sinh được báo cáo là bị phơi nhiễm trong ba tháng đầu và chỉ có bốn trẻ trong quý hai của thai kỳ, không có báo cáo về dị tật bẩm sinh. Một trăm mười trẻ bị phơi nhiễm với tenofovir alafenamidetrong ba tháng đầu và 50 trẻ trong ba tháng giữa, với ba trẻ bị dị tật bẩm sinh được ghi nhận trong ba tháng đầu. Có tổng cộng 267 trẻ phơi nhiễm với telbỉvudỉnevà ba trẻ được báo cáo bị dị tật bẩm sinh; Ngoài ra, telbivudine đã được nghiên cứu và báo cáo là an toàn trong một số thử nghiệm lâm sàng [69,70 1.
Cơ quan đăng ký cũng đã thu thập dữ liệu về bệnh nhân chỉ nhiễm HBV. Tính đến tháng 7 năm 2018, cơ quan đăng ký đã thu thập được dữ liệu của 837 trường hợp mang thai chỉ nhiễm HBV.
11 trường hợp dị tật bẩm sinh đã được báo cáo trong số 785 trẻ sinh sống. Không có kiểu dị tật nào trong số các dạng dị tật bẩm sinh được báo cáo [ 82 1.
Có những hạn chế quan trọng đối với những quan sát này. Cơ quan đăng ký phụ thuộc vào báo cáo tự nguyện và thông tin không được xác minh. Việc theo dõi lâu dài còn hạn chế, và không có các nỗ lực xác định chẩn đoán dị tật bẩm sinh. Hơn nữa, có sẵn dữ liệu về dị tật bẩm sinh trong số trẻ sinh sống, nhưng không có dữ liệu về sẩy thai hoặc chậm phát triển sau đó. Phần lớn dữ liệu lâm sàng đối với lamivudìnevà tenofovir disoproxil fumaratevì những loại thuốc này cũng được sử dụng để điều trị nhiễm HIV.
Các biến cố bất lợi tiềm ẩn khác – Một số tác dụng bất lợi của các nucleos(t)ide analogue đã được mô tả, bao gồm tổn thương ty thể, nhiễm axit lactic, gan nhiễm mỡ cấp tính và có thể là các bất thường ở xương.
- Nhiễm toan lactic có triệu chứng – Nhiễm toan lactic có triệu chứng đã được báo cáo ở trẻ sinh ra từ mẹ bị HIV phơi nhiễm với một số thuốc kháng retrovirus (bao gồm các thuốc nucleos(t)ide analogues) trong tử cung, nhưng nó không được quan sát thấy ở trẻ sơ sinh phơi nhiễm với thuốc kháng virus HBV trong tử cung. Do đó, theo dõi nhiễm toan lactic ở trẻ là không cần thiết nếu mẹ chỉ dùng thuốc kháng virus HBV. (See “Safety and dosing of antiretroviral medications in pregnancy”,section on ‘Mitochondrial toxicity’.)
- Bất thường ở xương – TDF có liên quan đến giảm mật độ khoáng của xương, thường ổn định khi tiếp tục sử dụng. Có những lo ngại về ảnh hưởng của TDF dùng cho mẹ đối với sự tàng trưởng và phát triển của thai nhi; tuy nhiên, các nghiên cứu đánh giá trẻ sinh ra từ những phụ nữ được nhận TDF trong thai kỳ nhìn chung là an toàn [ 83-86 1. Ví dụ, trong thử nghiệm ngẫu nhiên được mô tả ở trên [ 76 1, trong đó phụ nữ chỉ bị nhiễm HBV nhận TDF hoặc giả dược từ 28 tuần tuổi thai đến hai tháng sau khi sinh, không có ảnh hưởng đến mật độ xương của mẹ hoặc trẻ một năm sau khi sinh ở 140 bà mẹ và 137 trẻ được đánh giá [ 86]. Mặc dù một nghiên cứu khác cho thấy trẻ sinh ra từ những bà mẹ nhiễm HIV phơi nhiễm với TDF có hàm lượng khoáng trong xương thấp hơn 12% trong tháng đầu tiên của cuộc đời so với những trẻ không phơi nhiễm với tenofovir [ 87 1, nhưng ý nghĩa lâm sàng và lâu dài của những phát hiện này là không chắc chắn.
Một dạng bào chế mới hơn của tenofovir, tenofovir alafenamide, có thể ít độc tính trên xương hơn so với TDF, nhưng chúng tôi không sử dụng tenofovir alafenamide tại thời điểm này trong thời kỳ mang thai do thiếu dữ liệu về tính an toàn. (See ‘Maternal antiviral therapy to prevent transmission’above.)
- Ảnh hưởng đến tăng trưởng – Các nghiên cứu chủ yếu trên quần thể HIV không cho thấy ảnh hưởng của TDF đối với cân nặng khi sinh, mặc dù có các kết quả mâu thuẫn về ảnh hưởng đến chu vi vòng đầu và tăng trưởng (ví dụ, chiều dài) [ 84,85,88,89 Ị. Tuy nhiên, trong một nghiên cứu đánh giá 646 phụ nữ mang thai nhiễm HIV nhận TDF, không có mối liên quan giữa thời gian phơi nhiễm tenofovir trong tử cung và sự tăng trưởng của xương dài thai nhi, được đánh giá bằng siêu âm [ 90 Ị.
- Sảy thai – Interferon có liên quan đến tác dụng gây sẩy thai ở khỉ rhesus [ 79 Ị. Không có báo cáo nào như vậy ở người [ 91 1; tuy nhiên, vì dữ liệu còn hạn chế, tất cả phụ nữ đang điều trị bằng interferon phải sử dụng biện pháp tránh thai và phải ngừng dùng interferon nếu có thai. (See ‘Women who are pregnant’above.)
6. Tóm tắt và khuyến cáo
- Nhiễm vi-rút viêm gan B (HBV) trong thai kỳ gây ra các vấn đề quản lý duy nhất cho cả mẹ và thai nhi. Chúng bao gồm ảnh hưởng của HBV đến sức khỏe mẹ và thai nhi, ảnh hưởng của thai kỳ đối với quá trình lây nhiễm HBV, điều trị HBV trong thai kỳ và dự phòng lây truyền từ mẹ sang con (See ‘Introduction’above.)
- Nhiễm HBV cấp trong thai kỳ thường không nặng và không liên quan đến tăng tỷ lệ tử vong hoặc gây quái thai. Điều trị chủ yếu là hỗ trợ. Tuy nhiên, HBV cấp tính có liên quan đến sự lây truyền từ mẹ sang con. Nếu mẹ vẫn dương tính với kháng nguyên bề mặt viêm gan B (HBsAg) hoặc có HBV DNA có thể phát hiện được, trẻ nên được tiêm globulin miễn dich viêm gan B(HBIG) ngoài việc tiêm vắc xin viêm gan B thường quy. Liệu pháp kháng vi-rút cho mẹ cũng có thể được chỉ định để làm giảm nguy cơ lây truyền (algorithm 1). (See ‘Acute Hepatitis B virus infection’a bo ve a n d ‘Prevention of mother-to-child transmission’above.)
- Đối với các bà mẹ bị HBV mạn tính, tác động của nhiễm HBV đối với trẻ sơ sinh chưa được xác định rõ và dữ liệu còn mâu thuẫn. Tuy nhiên, phụ nữ bị xơ gan có nguy cơ đáng kể đối với các biến chứng chu sinh và kết cục kém của mẹ và thai nhi, bao gồm chậm tăng trưởng trong tử cung, nhiễm trùng trong tử cung, sinh non và thai chết trong tử cung. (See ‘Effect of chronic HBV on pregnancy outcomes’a bo ve.)
- Mang thai thường được dung nạp tốt ở những phụ nữ nhiễm vi-rút viêm gan B (HBV) mạn tính mà không bị bệnh gan tiến triển. Tuy nhiên, những bà mẹ có HBsAg dương tính nên được theo dõi chặt chẽ trong thời kỳ mang thai và hậu sản, vì những phụ nữ này có nguy cơ phát triển đợt bùng phát viêm gan. (See ‘Impact of pregnancy on the natural history of chronic HBV’above.)
- Cần đánh giá nhiều yếu tố khác nhau khi quyết định quản lý thai phụ bị HBV mạn tính trong thai kỳ, bao gồm chỉ định điều trị, thời gian điều trị dự kiến, tác dụng bất lợi tiềm tàng đối với thai nhi, nguy cơ phát triển kháng thuốc. (See ‘Management considerations’above.)
- Trẻ được tiêm HBIG và liều vắc-xin viêm gan B đầu tiên sau khi sinh có thể bú sữa mẹ. Điều quan trọng là những trẻ như vậy phải hoàn thành lịch trình tiêm chủng. Nếu tiếp tục liệu pháp kháng vi-rút sau khi sinh, lượng tenofovir thấp được phát hiện trong sữa mẹ, không có bất kỳ tác dụng sinh học nào đối với trẻ bú mẹ. Tuy nhiên, dữ liệu còn hạn chế và quyết định cho con bú phải dựa trên sở thích của bệnh nhân. (See ‘Breastfeeding and transmission’above and ‘Breastfeeding’above.)
- Tỷ lệ lây nhiễm ở trẻ sinh ra từ những bà mẹ có HBsAg dương tính không được nhận bất kỳ hình thức dự phòng sơ sinh nào cao tới 90%. Tuy nhiên, dùng HBIG và vắc xin viêm gan B cho trẻ sau khi sinh có thể làm giảm ít nhất 95% sự lây truyền. Các yếu tố nguy cơ lây truyền quan trọng nhất, mặc dù đã được điều trị dự phòng, dường như là kháng nguyên e viêm gan B dương tính (HBeAg) ở mẹ và tải lượng vi-rút HBV ở mẹ cao. (See ‘Risk of transmission* above and ‘Risk factors for transmission*above.)
- Xét nghiệm HBsAg nên được thực hiện trên tất cả phụ nữ trong lần khám thai đầu tiên và lặp lại vào cuối thai kỳ ở những người có nguy cơ nhiễm HBV cao. Trẻ sơ sinh của bà mẹ có HBsAg dương tính nên được tiêm chủng chủ động – thụ động (HBIG và vắc-xin viêm gan B) trong vòng 12 giờ sau khi sinh và sau đó hoàn tất loạt vắc-xin viêm gan B ( algorithm 1). (See ‘Maternal screening*above and “Hepatitis B virus immunization in infants, children, and adolescents”, section on ‘Routine infant immunization’.)
- Ngoài tiêm chủng chủ động- thụ động cho trẻ sơ sinh, liệu pháp kháng vi-rút cho mẹ có thể làm giảm nguy cơ lây truyền từ mẹ sang con. Tầm quan trọng của liệu pháp kháng vi-rút tăng lên khi tải lượng vi-rút tăng. Đối với những bà mẹ chưa điều trị, chúng tôi xét nghiệm nồng độ HBV DNA ở tuần thứ 26 đến 28 ( ẩĩ>algorithm 1). Đối với phụ nữ mang thai có tải lượng vi-rút HBV > 2 X 105 đơn vị quốc tế/mL (> 106 copies/mL), chúng tôi khuyến nghị liệu pháp kháng vi-rút (Grade 1B). Chúng tôi bắt đầu liệu pháp kháng vi-rút khi thai được 28 đến 30 tuần. Chúng tôi ưu tiên tenofovir disoproxil fumarate vì nó dường như an toàn trong thai kỳ và nguy cơ kháng thuốc thấp. Bệnh nhân nên được theo dõi về đợt bùng phát nếu ngừng liệu pháp kháng vi-rút sau khi sinh. (See ‘Prevention of mother-to-chìld transmission’above and ‘Safety of antiviral agents in pregnancy’above.)
7. Tham khảo
1. Sookoian s. Liver disease during pregnancy: acute viral hepatitis. Ann Hepatol 2006; 5:231.
2. Hieber JP, Dalton D, Shorey J, Combes B. Hepatitis and pregnancy. J Pediatr 1977; 91:545.
3. Jonas MM. Hepatitis B and pregnancy: an underestimated issue. Liver Int 2009; 29 Suppl 1:133.
4. Degertekin B, Lok AS. Indications for therapy in hepatitis B. Hepatology 2009; 49:S129.
5. Potthoff A, Rifai K, Wedemeyer H, et al. Successful treatment of fulminant hepatitis B during pregnancy, z Gastroenterol 2009; 47:667.
6. Rawal BK, Parida s, Watkins RP, et al. Symptomatic reactivation of hepatitis B in pregnancy. Lancet 1991; 337:364.
7. Giles M, Visvanathan K, Lewin s, et al. Clinical and virological predictors of hepatic flares in pregnant women with chronic hepatitis B. Gut 2015; 64:1810.
8. Lin HH, Wu WY, Kao JH, Chen DS. Hepatitis B post-partum e antigen clearance in hepatitis B carrier mothers: Correlation with viral characteristics. J Gastroenterol Hepatol 2006:21:605.
9. ter Borg MJ, Leemans WF, de Man RA, Janssen HL. Exacerbation of chronic hepatitis B infection after delivery. J Viral Hepat 2008; 15:37.
10. Yang YB, Li XM, Shi ZJ, Ma L. Pregnant woman with fulminant hepatic failure caused by hepatitis B virus infection: a case report. World J Gastroenterol 2004; 10:2305.
11. Nguyen G, Garcia RT, Nguyen N, et al. Clinical course of hepatitis B virus infection during pregnancy. Aliment Pharmacol Ther 2009; 29:755.
12. Tan HH, Lui HF, Chow wc. Chronic hepatitis B virus (HBV) infection in pregnancy. Hepatol Int 2008; 2:370.
13. Sõderstrõm A, Norkrans G, Lindh M. Hepatitis B virus DNA during pregnancy and post partum: aspects on vertical transmission. Scand J Infect Dis 2003; 35:814.
14. Lao TT, Chan BC, Leung wc, et al. Maternal hepatitis B infection and gestational diabetes mellitus. J Hepatol 2007; 47:46.
15. Lao TT, Tse KY, Chan LY, et al. HBsAq carrier status and the association between gestational diabetes with increased serum ferritin concentration in Chinese women. Diabetes Care 2003; 26:3011 ■
16. Lobstein s, Faber R, Tillmann HL. Prevalence of hepatitis B among pregnant women and its impact on pregnancy and newborn complications at a tertiary hospital in the eastern part of Germany. Digestion 2011; 83:76.
17. Connell LE, Salihu HM, Salemi JL, et al. Maternal hepatitis B and hepatitis c carrier status and perinatal outcomes. Liver Int 2011; 31:1163.
18. Wong s, Chan LY, Yu V, Ho L. Hepatitis B carrier and perinatal outcome in singleton pregnancy. Am J Perinatol 1999; 16:485.
19. Tse KY, Ho LF, Lao T. The impact of maternal HBsAg carrier status on pregnancy outcomes: a case-control study. J Hepatol 2005; 43:771.
20. Reddick KL, Jhaveri R, Gandhi M, et al. Pregnancy outcomes associated with viral hepatitis. J Viral Hepat 2011; 18:e394.
21. Safir A, Levy A, Sikuler E, Sheiner E. Maternal hepatitis B virus or hepatitis c virus carrier status as an independent risk factor for adverse perinatal outcome. Liver Int 2010; 30:765.
22. Shaheen AA, Myers RP. The outcomes of pregnancy in patients with cirrhosis: a population-based study. Liver Int 2010; 30:275.
23. Terrault NA, Lok ASF, McMahon BJ, et al. update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology 2018; 67:1560.
24. Society for Maternal-Fetal Medicine (SMFM), Dionne-Odom J, Tita AT, Silverman NS. #38: Hepatitis B in pregnancy screening, treatment, and prevention of vertical transmission. Am J Obstet Gynecol 2016; 214:6.
25. American Academy of Pediatrics. Hepatitis B. In: Red Book: 2015 Report of the Committ ee on Infectious Diseases, 30th ed, Kimberlin DW, Brady MT, Jackson MA, Long ss (Eds), American Academy of Pediatrics, Elk Grove Village, IL 2015. p.400.
26. Cundy KC, Sueoka c, Lynch GR, et al. Pharmacokinetics and bioavailability of the anti¬human immunodeficiency virus nucleotide analog 9-KR)-2- (phosphonomethoxv)propylladenine (PMPA) in dogs. Antimicrob Agents Chemother 1998:42:687.
27. Van Rompay KK, Hamilton M, Kearney B, Bischofberqer N. Pharmacokinetics of tenofovir in breast milk of lactating rhesus macaques. Antimicrob Agents Chemother 2005;
49:2093.
28. Benaboud s, Pruvost A, Coffie PA, et al. Concentrations of tenofovir and emtricitabine in breast milk of HIV-1-infected women in Abidjan, Cote d’Ivoire, in the ANRS 12109 TEmAA Study, Step 2. Antimicrob Agents Chemother 2011; 55:1315.
29. Ehrhardt s, Xie c, Guo N, et al. Breastfeeding while taking lamivudine or tenofovir disoproxil fumarate: a review of the evidence. Clin Infect Dis 2015; 60:275.
30. Waitt c, Olagunju A, Nakalema s, et al. Plasma and breast milk pharmacokinetics of emtricitabine, tenofovir and lamivudine using dried blood and breast milk spots in nursing African mother-infant pairs. J Antimicrob Chemother 2018; 73:1013.
31. Gouraud A, Millaret A, Bernard N, et al. Tenofovir exposure through breast feeding: Ser urn concentrations in neonates and clinical follow-up. Fundam Clin Pharmacol. 2012;26 (Suppl 1):9
32. Pan CQ, Mi LJ, Bunchorntavakul c, et al. Tenofovir disoproxil fumarate for prevention of vertical transmission of hepatitis B virus infection by highly viremic pregnant women: a case series. Dig Dis Sci 2012; 57:2423,
33. Ganne-Carrie N, Causse X, Zarski JP et al. Efficacy and safety results of tenofovir DF (TD F) treatment from the first trimester in HBV pregnant women in real-life clinical practic e. Hepatology. 2013;58 (Suppl 1):664A-5A
34. Lactmed. Tenofovir. http://toxnet.nlm.nih.goV/cgi-bin/sis/search2/f7./temp/~SOkg2H:1.
35. Stevens CE, Beasley RP, Tsui J, Lee wc. Vertical transmission of hepatitis B antigen in Taiwan. N Engl J Med 1975; 292:771.
36. Schillie s, Walker T, Veselsky s, et al. Outcomes of infants born to women infected with hepatitis B. Pediatrics 2015; 135:e1141.
37. Xu DZ, Yan YP, Choi BC, et al. Risk factors and mechanism of transplacental transmission of hepatitis B virus: a case-control study. J Med Virol 2002; 67:20.
38. Stevens CE, Toy PT, Tong MJ, et al. Perinatal hepatitis B virus transmission in the United States. Prevention by passive-active immunization. JAMA 1985; 253:1740.
39. Chen HL, Lin LH, Hu FC, et al. Effects of maternal screening and universal immunization to prevent mother-to-infant transmission of HBV. Gastroenterology 2012; 142:773.
40. Thompson ND, Perz JF, Moorman AC, Holmberg SD. Nonhospital health care-associated hepatitis B and c virus transmission: United States, 1998-2008. Ann Intern Med 2009; 150:33.
41. Guidelines for Perinatal Care. In: American Academy of Pediatrics and American Colleg e of Obstetricians and Gynecologists, 4th ed, Washington, DC 1997. p.286.
42. Soldan K, Ramsay M, Collins M. Acute hepatitis B infection associated with blood transfusion in England and Wales, 1991-7: review of database. BMJ 1999; 318:95.
43. Zou H, Chen Y, Duan z, et al. Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers. J Viral Hepat 2012; 19:e18.
44. Burk RD, Hwang LY, Ho GY, et al. Outcome of perinatal hepatitis B virus exposure is dependent on maternal virus load. J Infect Dis 1994; 170:1418.
45. Li XM, Shi MF, Yang YB, et al. Effect of hepatitis B immunoglobulin on interruption of
HBV intrauterine infection. World J Gastroenterol 2004; 10:3215.
46. Wiseman E, Fraser MA, Holden s, et al. Perinatal transmission of hepatitis B virus: an Australian experience. Med J Aust 2009; 190:489.
47. Wen WH, Chang MH, Zhao LL, et al. Mother-to-infant transmission of hepatitis B virus infection: significance of maternal viral load and strategies for intervention. J Hepatol 2013; 59:24.
48. Kubo A, Shlager L, Marks AR, et al. Prevention of vertical transmission of hepatitis B: an observational study. Ann Intern Med 2014; 160:828.
49. Lin HH, Lee TY, Chen DS, et al. Transplacental leakage of HBeAg-positive maternal blood as the most likely route in causing intrauterine infection with hepatitis B virus. J Pediatr 1987; 111:877,
50. Ohto H, Lin HH, Kawana T, et al. Intrauterine transmission of hepatitis B virus is closely related to placental leakage. J Med Virol 1987; 21:1.
51. Bai H, Zhang L, Ma L, et al. Relationship of hepatitis B virus infection of placental barrier and hepatitis B virus intra-uterine transmission mechanism. World J Gastroenterol 2007; 13:3625.
52. Zhang SL, Yue YF, Bai GQ, et al. Mechanism of intrauterine infection of hepatitis B virus. World J Gastroenterol 2004; 10:437.
53. Lopez M, Coll o. Chronic viral infections and invasive procedures: risk of vertical transmission and current recommendations. Fetal Diaqn Ther 2010; 28:1.
54. Towers cv, Asrat T, Rumney p. The presence of hepatitis B surface antigen and deoxyribonucleic acid in amniotic fluid and cord blood. Am J Obstet Gynecol 2001; 184:1514.
55. Yi w, Pan CQ, Hao J, et al. Risk of vertical transmission of hepatitis B after amniocentesis in HBs antigen-positive mothers. J Hepatol 2014; 60:523,
56. Ko TM, Tseng LH, Chang MH, et al. Amniocentesis in mothers who are hepatitis B virus carriers does not expose the infant to an increased risk of hepatitis B virus infection. Arch Gynecol Obstet 1994; 255:25.
57. Chen LZ, Zhou WQ, Zhao ss, et al. A nested case-control study of maternal-neonatal transmission of hepatitis B virus in a Chinese population. World J Gastroenterol 2011; 17:3640.
58. Song YM, Sung J, Yang s, et al. Factors associated with immunoprophylaxis failure against vertical transmission of hepatitis B virus. Eur J Pediatr 2007; 166:813.
59. Wang J, Zhu Q, Zhang X. Effect of delivery mode on maternal-infant transmission of hepatitis B virus by immunoprophylaxis. Chin Med J (Engl) 2002; 115:1510.
60. Yang J, Zeng XM, Men YL, Zhao LS. Elective caesarean section versus vaginal delivery for preventing mother to child transmission of hepatitis B virus–a systematic review. Virol J 2008; 5:100.
61. Chang MS, Gavini s, Andrade PC, McNabb-Baltar J. Caesarean section to prevent transmission of hepatitis B: a meta-analysis. Can J Gastroenterol Hepatol 2014; 28:439.
62. Tran TT. Hepatitis B in Pregnancy. Clin Infect Dis 2016; 62 Suppl 4:S314.
63. Beasley RP, Stevens CE, Shiao IS, Meng HC. Evidence against breast-feeding as a mechanism for vertical transmission of hepatitis B. Lancet 1975; 2:740.
64. Hill JB, Sheffield JS, Kim MJ, et al. Risk of hepatitis B transmission in breast-fed infants of chronic hepatitis B carriers. Obstet Gynecol 2002; 99:1049.
65. Schillie s, Vellozzi c, Reingold A, et al. Prevention of Hepatitis B Virus Infection in the United States: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep 2018; 67:1.
66. Chen HL, Lee CN, Chang CH, et al. Efficacy of maternal tenofovir disoproxil fumarate in interrupting mother-to-infant transmission of hepatitis B virus. Hepatology 2015; 62:375.
67. Brown RS Jr, McMahon BJ, Lok AS, et al. Antiviral therapy in chronic hepatitis B viral infection during pregnancy: A systematic review and meta-analysis. Hepatology 2016; 63:319.
68. Pan CQ, Duan z, Dai E, et al. Tenofovir to Prevent Hepatitis B Transmission in Mothers with High Viral Load. N Engl J Med 2016; 374:2324.
69. Han GR, Cao MK, Zhao w, et al. A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection. J Hepatol 2011; 55:1215.
70. Pan CQ, Han GR, Jiang HX, et al. Telbivudine prevents vertical transmission from HBeAg- positive women with chronic hepatitis B. Clin Gastroenterol Hepatol 2012; 10:520.
71. Shi z, Yang Y, Ma L, et al. Lamivudine in late pregnancy to interrupt in utero transmission of hepatitis B virus: a systematic review and meta-analysis. Obstet Gynecol 2010; 116:147.
72. Xu WM, Cui YT, Wang L, et al. Lamivudine in late pregnancy to prevent perinatal transmission of hepatitis B virus infection: a multicentre, randomized, double-blind, placebo-controlled study. J Viral Hepat2009; 16:94.
73. Visvanathan K, Dusheiko G, Giles M, et al. Managing HBV in pregnancy. Prevention, prophylaxis, treatment and follow-up: position paper produced by Australian, UK and New Zealand key opinion leaders. Gut 2016; 65:340.
74. Nguyen V, Tan PK, Greenup AJ, et al. Anti-viral therapy for prevention of perinatal HBV transmission: extending therapy beyond birth does not protect against post-partum flare. Aliment Pharmacol Ther 2014; 39:1225.
75. National Academies of Sciences, Engineering, and Medicine. A national strategy for the elimination of hepatitis B and c. Washington, DC. The National Academies Press, 2017.
76. Jourdain G, Ngo-Giang-Huong N, Harrison L, et al. Tenofovir versus Placebo to Prevent Perinatal Transmission of Hepatitis B. N Engl J Med 2018; 378:911.
77. World Health Organization. Immunization, Vaccines and Biologicals: Data, statistics and graphics, http://www.who.int/immunization/monitoring_surveillance/data/en/ (Accesse d on March 19, 2018).
78. Hill HA, Elam-Evans LD, Yankey D, et al. Vaccination Coverage Among Children Aged 19-
35 Months – United States, 2016. MMWR Morb Mortal Wkly Rep 2017; 66:1171.
79. Intron-A [package insert], Kenilworth, NJ. Schering Corporation; 1994.
80. Pan CQ, Duan ZP, Dai E, et al. Tenofovir disoproxil fumarate (TDF) reduces perinatal tran smission of hepatitis B virus in highly viremic mothers: A multi-center, prospective, ran domized and controlled study. Presented at the AASLD Liver Meeting 2015. San Francis co, 2015.
81. Hoyert DL, Mathews TJ, Menacker F, et al. Annual summary of vital statistics: 2004. Pediatrics 2006; 117:168.
82. Antiretroviral Pregnancy Registry Steering Committee. Antiretroviral Pregnancy Registr y Interim Report for 1 January 1989 through 31 July 2018. Wilmington, NC: Registry Coo rdinating Center; 2017. Available from URL: www.APRegistry.com. (Accessed on May 24, 2019).
83. Gill US, et al. Factors determining bone mineral density loss in chronic hepatitis B
patients: is tenofovir disoproxil fumarate the main culprit? Gut 2011; 60:A230.
84. Gibb DM, Kizito H, Russell EC, et al. Pregnancy and infant outcomes among HIV- infected women taking long-term ART with and without tenofovir in the DART trial. PLoS Med 2012; 9:e1001217.
85. Wang L, Kourtis AP, Ellington s, et al. Safety of tenofovir during pregnancy for the mother and fetus: a systematic review. Clin Infect Dis 2013; 57:1773.
86. Salvador! N, Fan B, Teeyasoontranon w, et al. Maternal and Infant Bone Mineral Density 1 Year After Delivery in a Randomized, Controlled Trial of Maternal Tenofovir Disoproxil Fumarate to Prevent Mother-to-child Transmission of Hepatitis B Virus. Clin Infect Dis 2019; 69:144.
87. Siberry GK, Jacobson DL, Kalkwarf HJ, et al. Lower Newborn Bone Mineral Content Associated With Maternal Use of Tenofovir Disoproxil Fumarate During Pregnancy. Clin Infect Dis 2015; 61:996.
88. Viganò A, Mora s, Giacomet V, et al. In utero exposure to tenofovir disoproxil fumarate does not impair growth and bone health in HIV-uninfected children born to HIV-infected mothers. Antivir Ther 2011; 16:1259.
89. Siberry GK, Williams PL, Mendez H, et al. Safety of tenofovir use during pregnancy:
early growth outcomes in HIV-exposed uninfected infants. AIDS 2012; 26:1151.
90. Jao J, Abrams EJ, Phillips T, et al. In utero Tenofovir Exposure Is not Associated With
Fetal Long Bone Growth. Clin Infect Dis 2016; 62:1604.
91. Trotter JF, Zygmunt AJ. Conception and pregnancy during interferon-alpha therapy for chronic hepatitis c. J Clin Gastroenterol 2001; 32:76.

* Based upon findings on noninvasive testing or liver biopsy performed during the initial evaluation. Patients with advanced fibrosis determined by noninvasive methods should be evaluated using a second method, and if results are concordant, consider managing the same way as patients with cirrhosis.
5I The American Association for the study of Liver Diseases (AASLD) recommends using an ALT >35 U/L for men and >25 U/L for women as the upper limit of normal (ULN) rather than local laboratory values.
A Refer to UpToDate topic on “Hepatitis B virus: Overview of management” for a discussion of monitoring.
0 Refer to UpToDate topic on “Hepatitis B virus: Overview of management” for a discussion of indications for biopsy.
§ Adefovir, lamivudine, and telbivudine are not recommended due to a high rate of resistance after the first year and/or weak antiviral activity.
¥ Refer to UpToDate topic on “Hepatitis B virus: Overview of management” for a discussion of which agent to use.
t Up to 50% of patients who achieve HBeAg seroconversion can experience a virologic relapse after discontinuing treatment with oral agents. Thus, some providers prefer to treat until HBsAg-loss.
t For most patients, antiviral therapy should be continued indefinitely. However, treatment discontinuation may be considered in persons without cirrhosis who have demonstrated loss of HBsAg and in selected patients who have had undetectable serum HBV DNA for >2 to 3 years and agree to close monitoring after stopping treatment. Persons who stop antiviral therapy should be monitored every month for the first six months. Refer to the UpToDate topic on management of hepatitis B virus infection for a detailed discussion of the risks and benefits of stopping antiviral therapy in this setting.
** This includes HBeAg-positive adults with cirrhosis who seroconvert to anti-HBe on therapy.
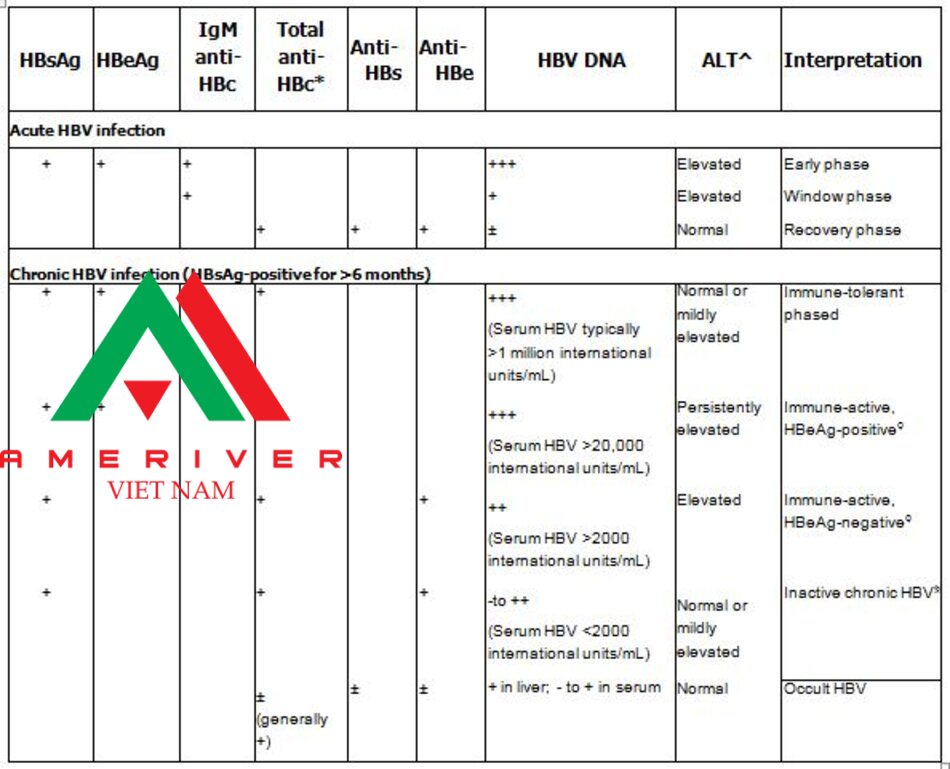
* This test is typically ordered as total anti-HBc, which includes IgM and IgG.
5I The upper limits of normal for ALT in healthy adults are reported to be 29 to 33 units/L for males and 19 to 25 units/L for females. For healthy children after infancy, the upper limits of normal are 25 to 38 units/L and 22 to 31 units/L for boys and girls, respectively. A For patients with immune-tolerant chronic hepatitis B, liver biopsy or noninvasive tests show no fibrosis and minimal inflammation. This is the initial phase seen in patients with perinatally acquired HBV infection.
0 For patients with immune active chronic hepatitis B, liver biopsy or noninvasive tests show chronic hepatitis with moderate or severe necroinflammation with or without fibrosis. For patients who are HBeAg positive, immune-active chronic hepatitis B (also known as the clearance phase) can last for 10 to 20 years, and may be associated with the loss of HBeAg. For patients who are HBeAg negative, immune-active chronic hepatitis B is associated with immune reactivation and is also referred to as HBeAg- negative chronic hepatitis B or HBeAg-negative replicative phase.
§ Patients with inactive chronic hepatitis B are HBeAg negative. In such patients, liver biopsy confirms the absence of significant necroinflammation, but biopsy or noninvasive testing show variable levels of fibrosis. This stage has also been referred to as the nonreplicative or carrier phase.
![Anti-HBc: hepatitis B core antibody; anti-HBe: hepatitis B e antibody; anti-HBs: hepatitis B surface antibody; HBeAg: hepatitis B e antigen; HBIG: hepatitis B immune globulin; HBsAg: hepatitis B surface antigen; HBV: hepatitis B virus. * Check anti-HBs and anti-HBc if mother is at high risk for HBV infection (eg, injection drug user, sexual partner or household contact has chronic HBV). Mothers with no evidence of prior HBV infection (ie, negative for HBsAg, anti- HBs, and anti-HBc ) should be vaccinated. In addition, such women should have HBsAg repeated late in pregnancy (approximately 28 weeks). 5] Women who have a high HBV DNA (>200,000 int. units/mL), elevated aminotransferase levels, and/or a positive HBeAg should be referred to a hepatologist to see if early initiation of antiviral medications is needed. A Start at 28 to 30 weeks gestation. We prefer tenofovir disoproxil fumarate rather than other antiviral agents. Refer to the topic on Hepatitis B and pregnancy for a more detailed discussion of treatment. 0 For those who continue antiviral therapy after delivery, the pros and cons of breastfeeding must be discussed with the mother. Refer to the topic on Hepatitis B and pregnancy for more detailed discussions of breastfeeding.](https://ameriver.com/wp-content/uploads/2021/04/b19_anh_4.jpg)
5] Women who have a high HBV DNA (>200,000 int. units/mL), elevated aminotransferase levels, and/or a positive HBeAg should be referred to a hepatologist to see if early initiation of antiviral medications is needed.
A Start at 28 to 30 weeks gestation. We prefer tenofovir disoproxil fumarate rather than other antiviral agents. Refer to the topic on Hepatitis B and pregnancy for a more detailed discussion of treatment.
0 For those who continue antiviral therapy after delivery, the pros and cons of breastfeeding must be discussed with the mother. Refer to the topic on Hepatitis B and pregnancy for more detailed discussions of breastfeeding.
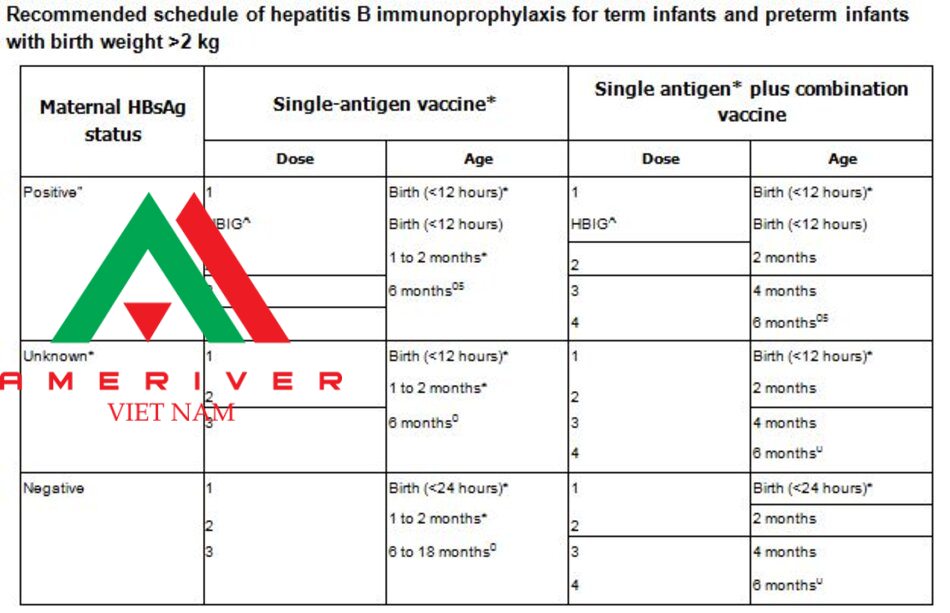
* Single-antigen vaccines (ie, Recombivax HB or Engerix-B) should be used for the birth dose. Combination vaccines (eg, Pediarix) cannot be administered at birth or before age 6 weeks.
n Infants born to HBsAg-positive mothers should receive immunoprophylaxis as recommended whether or not their mother received antiviral therapy during the third trimester.
A HBIG (0.5 mL) administered intramuscularly at a separate site (ie, different leg) from vaccine.
0 The final dose in the vaccine series should not be administered before age 24 weeks (164 days).
§ These infants should be tested for anti-HBs and HBsAg at age 9 to 12 months or 1 to 2 months after the last dose of hepatitis B vaccine. Testing should not be performed before age 9 months nor within 4 weeks of the most recent vaccine dose.
¥ Mothers should have blood drawn and tested for HBsAg as soon as possible after admission for delivery; if the mother is found to be HBsAg positive, the infant should receive HBIG as soon as possible but no later than age 7 days.
Adapted from: Schillie s, Vellozzi c, Reingold A, et al. Prevention of hepatitis B virus infection in the United States: Recommendations of the Advisory Committee on Immunization Practices. MMWR Recomm Rep 2018; 67:1.
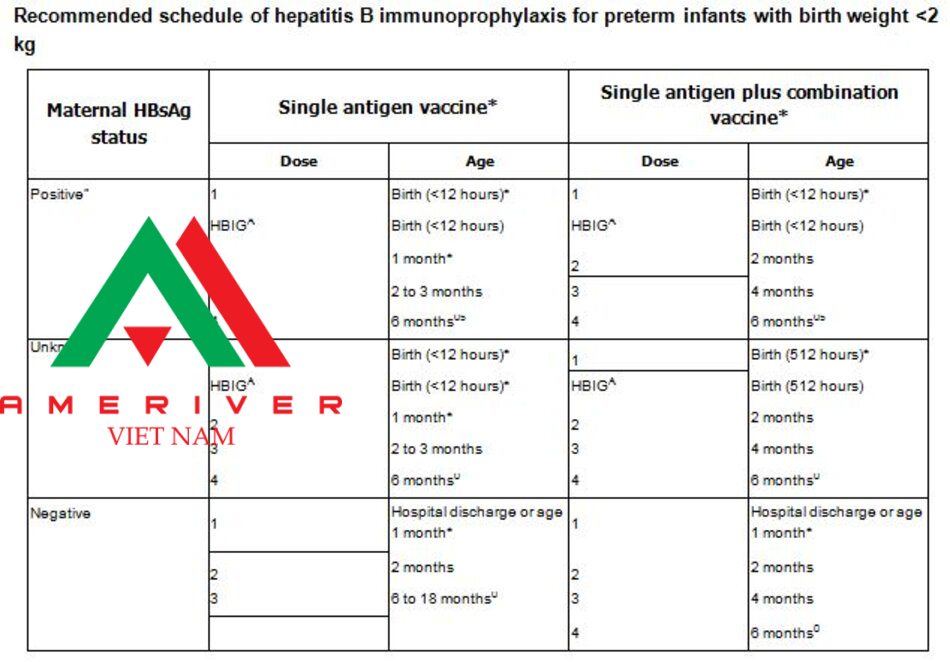
* Single-antigen vaccines (ie, Recombivax HB or Engerix-B) should be used for the birth dose. Combination vaccines (eg, Pediarix) cannot be administered at birth or before age 6 weeks.
n Infants born to HBsAg-positive mothers should receive immunoprophylaxis as recommended whether or not their mother received antiviral therapy during the third trimester.
A HBIG (0.5 mL) administered intramuscularly at a separate site (ie, different leg) from vaccine.
0 The final dose in the vaccine series should not be administered before age 24 weeks (164 days).
§ These infants should be tested for anti-HBs and HBsAg at age 9 to 12 months or one to two months after the last dose of hepatitis B vaccine. Testing should not be performed before age 9 months nor within four weeks of the most recent vaccine dose.


